金纳米颗粒(AuNPs)由于其独特的细胞生物学、生物医学化学、光学和电子特性,在诸如药物传输、光学传感或光热疗法等领域有着广泛的应用。能够进一步揭示金纳米颗粒在新生物医学应用的关键就是细胞摄取。尽管进行了大量该领域的研究,但是目前人们对影响纳米颗粒细胞内化的因素的理解仍然非常有限。通常认为,AuNPs能够跨越细胞膜是通过内吞途径,而其吸收效率取决于电荷以及纳米颗粒的大小、形状和表面化学。因此,带正电荷的纳米颗粒通常能够最有效的进入细胞内部,而相似尺寸的带负电或中性的纳米颗粒则出现细胞摄取的明显降低。但是,当AuNPs分散在生物流体中时,它们的表面主要被生物分子(例如蛋白质和脂质)覆盖,形成所谓的“蛋白质冠”,造成不管初始表面电荷如何,它们的性质会发生变化并且对吸收有着显著的影响。除此之外,使用外部分子对细胞内化过程进行有条件的调节,也是一个主要的挑战,目前的方法基本上局限于在酸性pH下不可逆地聚集使得AuNPs带正电荷,从而增强细胞摄取。
近期,由西班牙CIC biomaGUNE / Ciber-BBN的Jesús Mosquera和Luis M. Liz-Marzán等人报道了一种超分子化学方法来控制AuNPs的细胞摄取。他们通过带负电的pyranine分子来官能化AuNPs的表面,从而阻碍它们的细胞内化。添加超分子笼A后,由于超分子主客体的相互作用,复合物带负电荷的表面将会切换为带正电荷,并诱导AuNPs的细胞摄取(图1)。
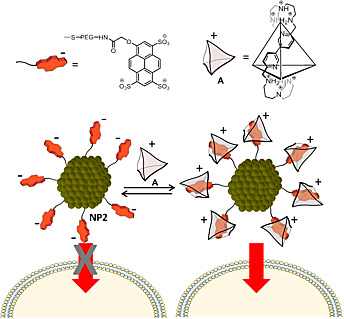
图1. 超分子控制AuNPs细胞摄取的示意图。图片来源:JACS
他们使用改进的Brust-Schiffrin方法,制备了平均核大小为2 nm的金纳米颗粒(NP1),并涂覆有硫醇化聚乙二醇(HS-PEG2000-NH2,Mw = 2000)。这种直接还原法确保所得到的氨基官能化AuNPs的表面被均匀覆盖。这些足够小的金纳米颗粒可以实现高负载率,并且最近的研究还显示,在体内研究中,这样的小金纳米颗粒表现出较低的肝脏积聚和良好的肾脏清除率。接下来他们将阴离子pyranine荧光团负载到金纳米颗粒NP1上。使用这些条件,在NP1中约有75%的氨基被修饰得到pyranine官能化的金纳米颗粒NP2(图1)。
如作者预期的一样,NP2在水溶液中呈现负的Zeta电位(Zp,-15±1 mV),而增加超分子笼A,能够引起向正Zp的转变。仅需添加1 μM的超分子笼A(0.2当量,相对于pyranine的浓度)便足以改变超分子纳米复合物的Zp至+15±2 mV。进一步添加超分子笼A,可以使得Zp最高达到+24 mV。这些结果清楚地表明了pyranine分子和超分子笼A之间的相互作用会引起AuNPs表面电荷的转换,同时保持胶体稳定。
作者接下来利用pyranine荧光团作为标记来研究NP2在人HeLa细胞中的细胞内化。细胞活性测定证实NP2、超分子笼A及其混合物在随后研究的浓度下无细胞毒性。在孵育1小时后,作者使用荧光显微镜并没有观察到NP2的摄取(80 nM,37 ℃)(图2A)。不过,在超分子笼A的存在下(5 μM)重复相同的实验时,校正总细胞荧光(CTCF)的平均值可增加至15倍,这证明发生了高效率的AuNPs内化(图2B)。

图2. 荧光显微镜下的Hela细胞 (A) 没有加入超分子笼A; (B) 加入超分子笼A。图片来源:JACS
作者另外使用了一种荧光标记的超分子笼A类似物A2来代替超分子笼A,他们发现超分子笼A2在NP2存在下可有效地内化,而且在孵育1小时后,A2所发射的荧光与来自NP2的pyranine的荧光会发生共定位。然而,这种共定位在24小时后效果会变差。 这些结果表明,超分子笼与金纳米粒子一起被摄取,但随后主客体复合体会分拆。 另外,他们使用这种超分子笼A2重复了图2中的摄取实验,结果显示在存在不同内吞途径的化学抑制剂的情况下,胞饮作用是携带着超分子笼A的金纳米颗粒摄取的主要途径。
已经知道,在复杂的生物流体中纳米颗粒与细胞一起培养会导致蛋白质冠的形成,那么这种现象是否会影响本文设计的主客体相互作用呢?作者使用含有10% 胎牛血清的培养基而不是纯的PBS溶液来重复细胞摄取实验。实验结果与PBS溶液中的结果类似,只是在获得相似CTCF的增加时需要更长的孵育时间,长达24小时。 这些数据证实,即使在复杂的生物介质中,超分子笼A和NP2之间的相互作用也足够强且足够特异。
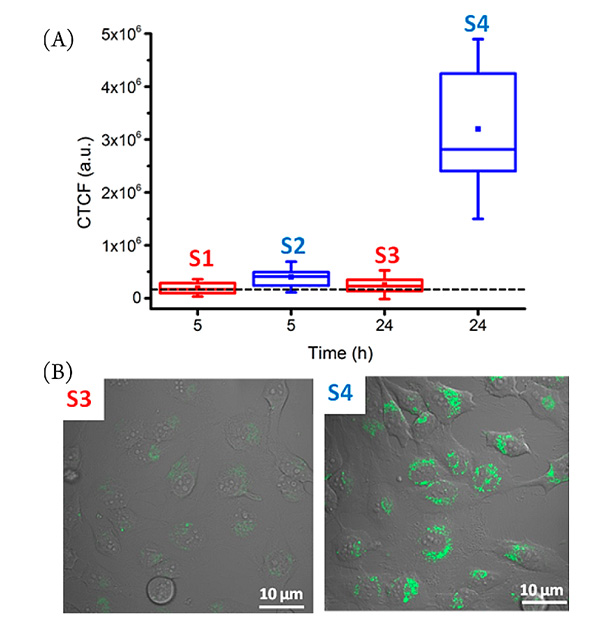
图3. 复杂的生物介质中NP2在Hela细胞中的摄取。图片来源:JACS
研究者们还发现了有趣的现象,当在NP2和超分子笼A(5 μM)的混合物中添加1当量(相对于超分子笼A)的pyranine时,与相同的实验相比,细胞摄取大致减半。由此,作者想到轮流加入超分子笼A和pyranine分子作为“开关”,来“打开”和“关闭”纳米颗粒的细胞摄取。如图4所示,向HeLa细胞中加入含有NP2(80 nM)的PBS溶液,在10分钟后没有内化(即“关闭”);加入超分子笼A(5 μM),10分钟后CTCF增加,意味着细胞摄取开始(即“打开”);再加入2当量的游离pyranine分子(10 μM),细胞摄取中止(即“关闭”);再加入1当量或者更多的超分子笼A,细胞摄取又被恢复,CTCF再次增加(即“打开”)。这些结果证明了作者想法确实可行。
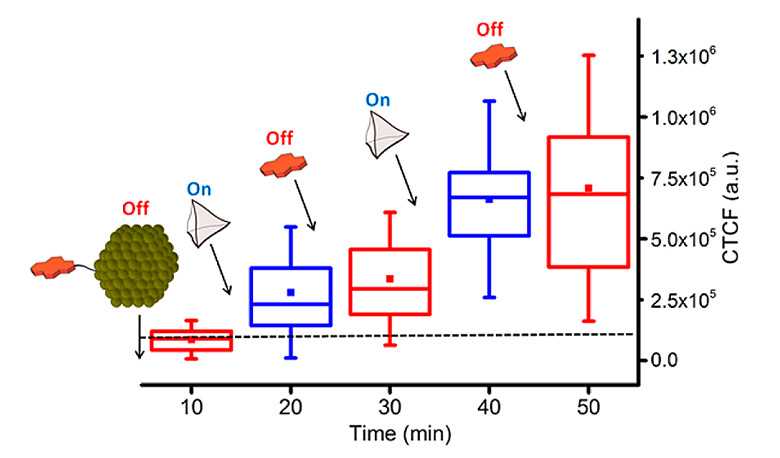
图4. CTCF随着加入超分子笼A和pyranine分子的变化图。图片来源:JACS
总之,作者通过超分子相互作用控制金纳米颗粒的细胞摄取,还可使用外部分子作为“开关”来控制这一过程。 该方法的基础是纳米颗粒表面的电荷调节作用,当AuNPs装饰有pyranine分子时不能穿过细胞膜, 然而加入能与pyranine分子相互作用的超分子笼后,就可被有效地摄取。 该方法与复杂的生物介质兼容,有望用于生物医学领域,例如药物递送和细胞成像等。
本文版权: X一MOL资讯