手性分子从原子组成上看一模一样,但是它们的空间结构却不同,就像左右手的关系,因此组成相同但空间结构互成镜像的分子被称为手性分子。在生命的演化过程中,自然界对某种手性往往有所偏爱,比如自然界中存在的氨基酸均为L-构型,而蛋白质的螺旋构象又大都右旋。组成相同而手性不同的两个分子在这个不对称的生物界中表现出的作用一般是不同的,甚至是相反的。其中最让人印象深刻的例子莫过于“反应停”(沙利度胺)事件,由于药厂并没有拆分沙利度胺的两个手性异构体,这个原本用于缓解妊娠反应的药物造成了大量“海豹畸形婴儿”的出生。为了避免类似惨剧,各国药品监管部门都要求外消旋药物分子进行手性拆分。这一举措极大提高了药物安全性,但手性分子的分离却不是个容易的过程。手性拆分过程中对手性的识别依赖于空间效应,由于没有通用的分离方法,不同种类的手性分子往往需要设计不同的分离策略。比如,使用基于色谱的方法来分离对映异构体,需要预先针对目标分子优化手性分离介质,成本高、耗时不说,还不一定能获得成功。而且,换一个目标分子,这个过程通常还要重来一遍,有些类似“一把钥匙开一把锁”。

图1. 沙利度胺。图片来源:Wikipedia
最近,以色列魏茨曼科学研究所的Ron Naaman教授和希伯来大学的Yossi Paltiel教授等人另辟蹊径,不再依赖于空间效应来识别手性,他们把关注点转向了磁性。手性分子的电荷再分布诱导电子自旋取向有一定的选择性,即手性诱导的自旋选择性(chiral-induced spin selectivity,CISS),这就意味着诱导自旋极化可能通过交换作用(exchange interaction)影响对映选择性识别。他们通过实验证明,手性分子与垂直磁化基底的相互作用具有对映选择性。这为手性分子的拆分找到了一个新的、通用的方法,可以让制药业与精细化工业的手性拆分变得容易且廉价。相关工作发表在Science 上。

图2. 利用磁性进行手性拆分示意图。图片来源:Palitel & Naaman
磁性和手性到底有没有关系?这个问题的历史已经超过一个世纪。在显微镜下成功分离手性酒石酸盐晶体的著名科学家巴斯德,就曾希望在磁场的作用下合成出只有一种手性的物质,但是没有成功。近来的研究表明,当电子在手性分子中运动时,它们的输运与自旋相关,首选的自旋取向取决于分子的手性和运动的方向。受此启发,Naaman教授和Paltiel教授研究团队预测手性诱导的自旋选择性有助于手性识别。随后他们设计实验以证明自己的猜想。以钴薄膜作为铁磁体(FM)基底,并在其上沉积一层金(厚度5 nm)。金不仅可以防止钴的氧化,还能固定含有巯基的分子,也不会影响铁磁体的磁性质和自旋输运性质。分离的目标物是基于L-和D-聚丙氨酸(PAL)的α螺旋低聚肽,具有稳定的螺旋结构,末端有巯基可以与铁磁体表面的金结合。二氧化硅纳米颗粒作为扫描电镜下的标志物,可连接到PAL低聚肽的另一端,帮助表征该低聚肽的吸附情况。当铁磁体基底磁化方向竖直向上(H+)和向下(H-)时,L-PAL在基底上的吸附情况有明显区别(图3i和ii),D-PAL在基底上的吸附情况也有明显区别(图3iii和iv)。从图3i至从图3iv,铁磁体基底的金表面吸附的二氧化硅纳米颗粒密度分别是(4 ± 0.4) × 1010 NPs/cm2、(6 ± 1) ×109NPs/cm2、(1 ± 0.2) ×1010 NPs/cm2和(4 ± 0.5) ×1010 NPs/cm2。这些数据表明,该方法能够影响L-PAL和D-PAL在铁磁体基底金表面的固定,表现出了良好的对映选择性。而将铁磁体去掉使用纯金基底时,磁场不会对L-PAL和D-PAL的吸附过程产生影响(图3v)。另外,当时间足够长时,无论磁场竖直向上或者向下,铁磁体基底金表面吸附的二氧化硅纳米颗粒的量都基本一样,这是因为这两种分子与金的结合能相同,而磁场和铁磁体只是阻碍了手性分子向金层的运动。
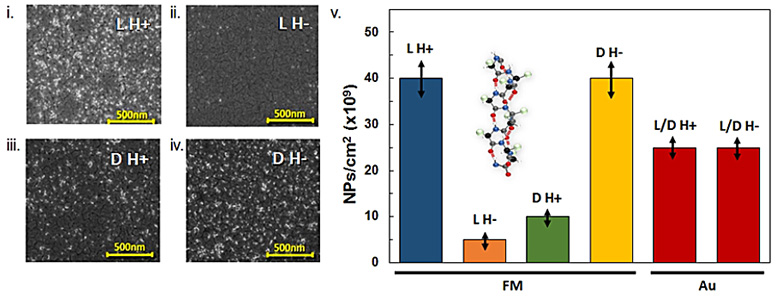
图3. 在磁场和铁磁体共同存在下L-和D-PAL在金表面的对映选择性吸附。图片来源:Science
接着作者研究了这种方法(铁磁体由钴换成镍)对双链DNA(20个碱基对)的影响,DNA的一端连有Cy3荧光染料,当DNA固定到金层上时可以检测到荧光。作者研究了在磁场方向竖直向上或者向下时金表面荧光强度与吸附时间的关系(图4A和4B)。结果证明,在不同的磁场方向作用下,双链DNA吸附到金表面的速率有很大差别。除了研究该方法对低聚肽和DNA的影响之外,作者还研究了对小分子(半胱氨酸)的影响(图4C)。可见对半胱氨酸分子的吸附在短时间内具有一定的对映选择性,随着时间增加吸附的对映选择性消失。
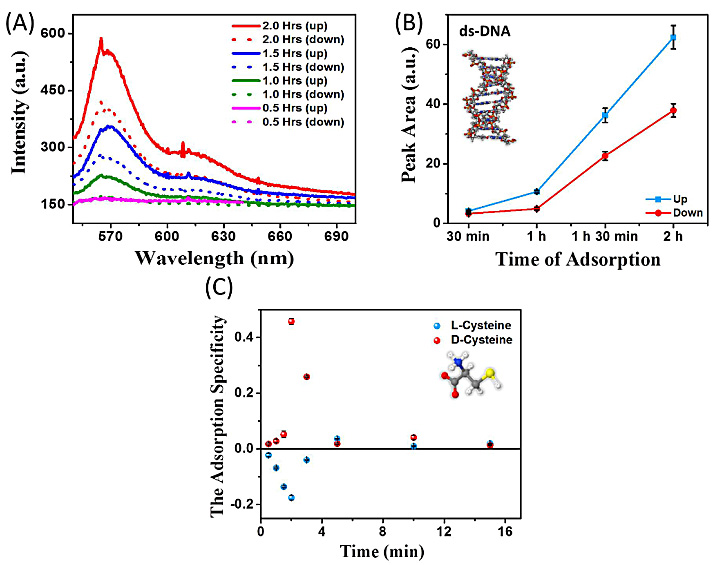
图4. 在磁场和铁磁体共同存在下金表面双链DNA及半胱氨酸分子的对映选择性吸附。图片来源:Science
以上实验证明铁磁体与磁场共同作用能选择性地分离手性分子,作者对此现象进行了解释。在铁磁体诱导的电偶极子极化条件下,分子的正负极分别有多余的空穴和电子,这种电荷极化伴随着自旋极化(spin polarization),正负极上的特异性自旋取向依赖于分子的手性(图5A)。如果手性分子的自旋与铁磁体基底的自旋存在交换作用,即它们中的电子自旋相互反平行,则它们将共享一个轨道,增加静电库仑能,分子-基底相互作用较稳定;然而,若二者的自旋平行,根据泡利不相容原理,二者形成分开的轨道,减少库仑相互作用,分子-基底相互作用较不稳定(图5B)。如果这种作用力足够大,就能够通过控制手性分子的运动达到分离手性分子的目的。作者还以氢原子和镍(铁磁体)为模型,利用密度泛函理论(density functional theory,DFT)研究了该相互作用能。
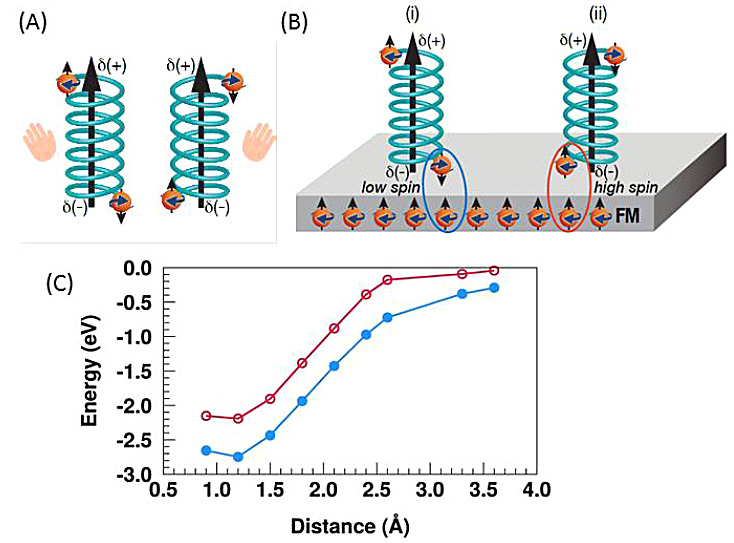
图5. 磁场和铁磁体影响手性分子的理论分析。图片来源:Science
综上,本文提出了利用磁场和铁磁体分离手性分子的策略,并用多肽、DNA及小分子实验证明这种策略的普适性。文中作者专门强调这种策略的基础并不是磁场与手性分子的直接作用,而是自旋极化分子与自旋极化基底(铁磁体)的磁交换作用(magnetic-exchange interaction)。该策略基于分子本身的结构分离手性分子,为实现手性分离提供了一种新颖、通用、有力的手段。
本文版权属于 X-MOL